PRACTICA 7: Juego de colores.
Practica 7: Juego de colores.
¿Cómo se consiguen los colores?
El sodio es el responsable de los amarillos y los dorados.
El bario produce los verdes
El cobre (carbonato de cobre / monocloruro de cobre) da lugar al color azul
Las sales de estroncio dan el color rojo
El titanio es el responsable de los destellos blancos y plateados.
Otros químicos usados habitualmente son:
El carbono, que provee el combustible.
Los oxidantes, que producen el oxígeno para la combustión.
El magnesio, que incrementa el brillo y la luminosidad.
El antimonio, que da un efecto glitter (es un efecto que marca los halos de los brillos).
El calcio, que da más intensidad a los colores.

Procedimiento:
Y por ultimo utilizamos el sulfato de cobre:
OBSERVACIONES (IMÁGENES Y DESCRIPCIÓN):
Cada sustancia, dependiendo de sus propiedades y de su combustión hará cambiar el color de la flama.
http://www.experimentoscaseros.info/2014/03/como-hacer-fuego-de-colores.html
http://es.slideshare.net/Marcela05/practica-10-completa
NOMBRE
|
NÚMERO DE LISTA
|
LINKS DE SU BLOG.
|
Lizeth Jazmín Montoya Torres
|
21
|
http://3clizethmontoyat22.blogspot.mx/
|
Salvador Osorio Gonzalez
|
22
|
http://3csalvadorosoriog23.blogspot.mx/
|
Michelle Alejandra Perez de Lara
|
23
|
http://3cmichelleperez24.blogspot.mx/
|
Mariana Valeria Pichardo Muñoz
|
24
| |
Alejandro Plascencia Romo
|
25
|
http://3calejandroplascenciar26.blogspot.mx/
|
Paula Daniela Quezada Delgado
|
26
| |
Luisa Fernanda Ramirez Andrade
| 27 |
http://3cluisaramireza28.blogspot.mx/
|
FECHA DE REALIZACIÓN:
16 De Diciembre Del 2015.
OBJETIVO:
Identificación de elementos mediante el color de la flama.
HIPÓTESIS:
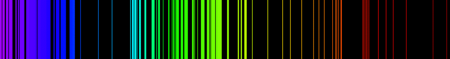 (Espectro de emisión de hierro.)
(Espectro de emisión de hierro.)
Las materias primas que conforman a algunos fuegos pirotécnicos son:
Materias primas:
OBJETIVO:
Identificación de elementos mediante el color de la flama.
HIPÓTESIS:
1.- Se cree que cada elemento tiene un color especifico cuando se combustiona.
2.- Pensamos que cada color del elemento puede variara según su numero de electrones de valencia.
2.- Pensamos que cada color del elemento puede variara según su numero de electrones de valencia.
INVESTIGACIÓN:
¿Que es el espectro de emisión atómica? Investiga la composición de los fuegos pirotécnicos.
El espectro de emisión atómica de un elemento es un conjunto de frecuencias de las ondas electromagnéticas emitidas por átomos de ese elemento, en estado gaseoso, cuando se le comunica energía. El espectro de emisión de cada elemento es único y puede ser usado para determinar si ese elemento es parte de un compuesto desconocido.- Es el conjunto de frecuencias de las ondas electromagnéticas emitidas por átomos del elemento.
- Para cada elemento, el espectro de emisión atómica es único y se puede usar para determinar si ese elemento es parte de un compuesto desconocido.

Composición de los fuegos pirotécnicos.
Las reacciones pirotécnicas ocurren por combustión no explosiva de materiales, que pueden generar llamas, chispas y humos.Las materias primas que conforman a algunos fuegos pirotécnicos son:
Materias primas:
- Pólvora negra
- Polvillo de acero, zinc y cobre
- Clorato de potasio
- Cloruro de calcio
- Nitrato de cobre, de bario, de estroncio
- Cloruro de litio
¿Cómo se consiguen los colores?
El sodio es el responsable de los amarillos y los dorados.
El bario produce los verdes
El cobre (carbonato de cobre / monocloruro de cobre) da lugar al color azul
Las sales de estroncio dan el color rojo
El titanio es el responsable de los destellos blancos y plateados.
Otros químicos usados habitualmente son:
El carbono, que provee el combustible.
Los oxidantes, que producen el oxígeno para la combustión.
El magnesio, que incrementa el brillo y la luminosidad.
El antimonio, que da un efecto glitter (es un efecto que marca los halos de los brillos).
El calcio, que da más intensidad a los colores.

Referencias:
https://es.wikipedia.org/wiki/Espectro_de_emisi%C3%B3n
http://es.slideshare.net/nildabel/espectro-de-emisin-atmica
http://www.quo.es/ser-humano/la-quimica-de-los-fuegos-artificiales
https://es.wikipedia.org/wiki/Pirotecnia
MATERIAL:
Modelos de Lewis:
Agua:
Cloruro de potasio:
Cloruro de Bario:
Cloruro de Estroncio:
Cloruro de Cobalto:
MATERIAL:
- Mechero de bunsen.
- Vidrio de reloj.
- Barra de grafito gruesa.
- Lentes.
SUSTANCIAS:
- Agua.
- Cloruro o sulfato de litio.
- Cloruro de sodio.
- Cloruro de potasio.
- Cloruro de bario.
- Cloruro de estroncio.
- Sulfato de cobre (II).
Modelos de Lewis:
Agua:
Cloruro de Litio:
Cloruro de sodio:
Cloruro de potasio:
Cloruro de Bario:
Cloruro de Estroncio:
Cloruro de Cobalto:
Sulfato de cobre:
PROCEDIMIENTO:
- Coloca una cantidad pequeña de agua en el vidrio de reloj.
SUSTANCIA
|
COLOR ORIGINAL
|
COLORACIÓN DE LA FLAMA
|
| Cloruro de litio | (Blanco) duro, cristalino, poco tenaz | Rojo |
| Cloruro de sodio | (Blanco) Duro, poco tenaz, cristalino | Naranja |
| Cloruro de potasio | (Blanco) Cristalino, poco tenaz | Morado |
| Cloruro de estroncio | (Blanco) Duro, poco tenaz | Magenta |
| Cloruro de cobalto | (Morado) Duro | Amarillo (con chispas) |
| Sulfato de cobre | (Azul) Duro | Verde. |
- Humedece la punta del grafito con el agua.
- Toma un poco de la primera sustancia con la punta del alambre o grafito. Acércala a la flama del mechero.
- Observa detenidamente el color que presenta la flama y anótalo en el cuadro.
- Introduce el grafito en el agua para limpiarlo y humedecerlo nuevamente.
- Repite la prueba de coloración a la flama con el resto de las sustancias.
Procedimiento:
- Lo principal era ver que todos tuvieran su lápiz con 10 cm (aproximadamente) de grafito descubierto.
- Después prendimos el mechero con ayuda de la maestra.
- Luego colocamos una pequeña cantidad de agua en el vidrio de reloj (Allí íbamos a introducir la punta del lápiz para limpiarlo).
- Y ya con eso, la maestra pasaba por los equipos para que tomáramos una pequeña cantidad de cada sustancia con el lápiz, para luego acercarla a la flama y ver que color aparecía.
Aquí se muestra como cambia el color de la flama al momento de acercarle el grafito del lapiz con un poco de cloruro de litio, es un rojo fuerte.
La siguiente sustancia fue el cloruro de sodio:
Se puede observar como la flama toma un color naranja.
La tercer sustancia fue el cloruro de potasio:
Se muestra como la flama es de color morado.
La siguiente sustancia fue el cloruro de Estroncio:
Se ve como la flama toma un color rojizo, pero no es tan rojo como el cloruro de litio es mas como magenta.
Después era el cloruro de cobalto:
Aunque en la imagen no se alcanza a ver muy bien, el color de la flama era un amarillo, pero también le salían chispitas.
Y por ultimo utilizamos el sulfato de cobre:
Con el cloruro de cobre pudimos observar una flama de color verde.
También que depende de la cantidad de electrones que tenga cada sustancia.
Y que si acercas por demasiado tiempo la mina del lápiz a la flama del mechero, esta desprenderá pedazos que saldrán disparados (es algo que no se debe hacer en el laboratorio) por ello es importante el uso de los lentes de seguridad.
CONCLUSIÓN:
Cuando un electrón gana energía salta a otra órbita y al volver a su órbita original emite luz, entonces suponemos que el color varia dependiendo de cuantos electrones tenga la sustancia y a que velocidad se mueven de una órbita a otra.
Ademas los colores que salieron parecidos, pensamos que fue porque tienen una cantidad similar de electrones.
El equipo investigo, y a continuación se muestra el color del que debió de haber salido la flama al momento de acercarle la sustancia.
Explicación:
El color de la flama del mechero cambiara de acuerdo a la sustancia que se le acerque.
Ademas es muy importante tomar en cuenta las medidas de seguridad adecuadas, que en este caso eran los lentes de seguridad para evitar accidentes.CONCLUSIÓN:
Ademas los colores que salieron parecidos, pensamos que fue porque tienen una cantidad similar de electrones.
- Naranja: cloruro de sodio.
- Anaranjado: cloruro de calcio.
- Morado: cloruro de potasio.
- Verde: sulfato de cobre.
- Azul: cloruro de cobre.
- Carmín (rojo fuerte): cloruro de litio.
- Rojo: cloruro de estroncio.
- Amarillo: cloruro de cobalto.
Explicación:
Por un lado, el fuego emite radiación electromagnética en forma de luz, por lo que según cómo sea su longitud de onda tendrá un color u otro. Cada elemento o compuesto químico tiene su propio patrón de ondas característico y, cuando los calentamos, su longitud de onda se altera y los vemos de otro color.
(Los colores también cambian dependiendo de la intensidad del calor).
(Los colores también cambian dependiendo de la intensidad del calor).
Referencias:
http://es.wikihow.com/hacer-fuego-de-coloreshttp://es.slideshare.net/Marcela05/practica-10-completa



































