PRACTICA 9: ¿En qué se parecen?
PRACTICA 9: ¿EN QUÉ SE PARECEN?
NOMBRE
|
NÚMERO DE LISTA
|
LINKS DE SU BLOG.
|
Lizeth Jazmín Montoya Torres
|
21
|
http://3clizethmontoyat22.blogspot.mx/
|
Salvador Osorio Gonzalez
|
22
|
http://3csalvadorosoriog23.blogspot.mx/
|
Michelle Alejandra Perez de Lara
|
23
|
http://3cmichelleperez24.blogspot.mx/
|
Mariana Valeria Pichardo Muñoz
|
24
| |
Alejandro Plascencia Romo
|
25
|
http://3calejandroplascenciar26.blogspot.mx/
|
Paula Daniela Quezada Delgado
|
26
| |
Luisa Fernanda Ramirez Andrade
| 27 |
http://3cluisaramireza28.blogspot.mx/
|
FECHA:
20 de enero del 2016
OBJETIVO:
Analiza las propiedades físicas y químicas de varios elementos e identifica diferencias y similitudes.
HIPÓTESIS:
Se cree que las sustancias que nos proporcionaría la maestra tendrían cierto grado de modificación, al punto en el que, cuando combináramos el cloruro de cobre y el ácido clorhídrico, serian totalmente diferentes, a comparación de como estaban en un inicio.
INVESTIGA:
Experimentos que realizó Dimitri Mendeleiev para clasificar a los elementos químicos.
Dmitri Ivánovich Mendeléyev
Fue un químico ruso, célebre por haber descubierto el patrón subyacente en lo que ahora se conoce como la tabla periódica de los elementos.
Dedicó gran parte de su vida a estudiar la expansión térmica de los elementos, las desviaciones de de los gases reales de lo ya enunciado en la ley de Boyle-Mariotte.
Sin embargo, su principal investigación fue la que concluyó con la enunciación de la ley periódica de los elementos químicos, más conocida como Tabla Periódica, y que se basó en el sistema periódico que recibe su nombre. Con dicha tabla, Dmitri Mendeléyev consiguió realizar una clasificación definitiva de los elementos.
El sistema periódico clasifica todos los elementos químicos, tanto naturales como creados, en base a su masa atómica de forma creciente. De esta forma, se ubican en la misma columna aquellos elementos que tengan algo en común. Con ello logró que aquellos elementos con un comportamiento químico parecido se localizaran en la misma columna.
Asimismo, Dmitri Mendeléyev alteró el orden de las masas para ordenarlos según sus propiedades cuando lo creyó necesario y, además, dejó huecos en blanco para nuevos elementos que se descubrieran en el futuro.
Su sistema incorporaba múltiples mejoras en la clasificación de los elementos existentes hasta entonces, como la combinación de pesos atómicos, o las semejanzas entre elementos. De esta forma, demostró que las propiedades correspondientes a los elementos químicos son funciones periódicas de sus pesos atómicos.

En 1869 ya se conocían 63 elementos, de los 90 que hay en la naturaleza.
Mendeleiev, plantea que las propiedades de los elementos tenían que dar respuesta a una ley periódica que aun no se conocía. Él se sentía convencido de sus pensamientos lo que lo llevó a realizar predicciones quizás algo arriesgadas para aquella época, pero que con el tiempo resultaron ser ciertas:
- Dudó del valor de la masa atómica de algunos elementos, como el berilio y el uranio, y les dio otros valores que consideraba más acertados.
- Cambiar el orden de las masas atómicas en algunos elementos, para que éstos se agrupasen de mejor manera, con otros elementos de propiedades análogas, como puede ser el caso del teluro-yodo, o el cobalto-níquel.
- Dejar espacios en la tabla, que correspondían a elementos que aun no se conocían, llegando a predecir las propiedades incluso antes de ser descubiertos. Este es el caso del galio, el germanio o el escandio.
Fue ésta última predicción su gran mérito, ya que pronosticó la existencia y correcta posición de elementos aun no descubiertos, asignándoles un nombre provisional.
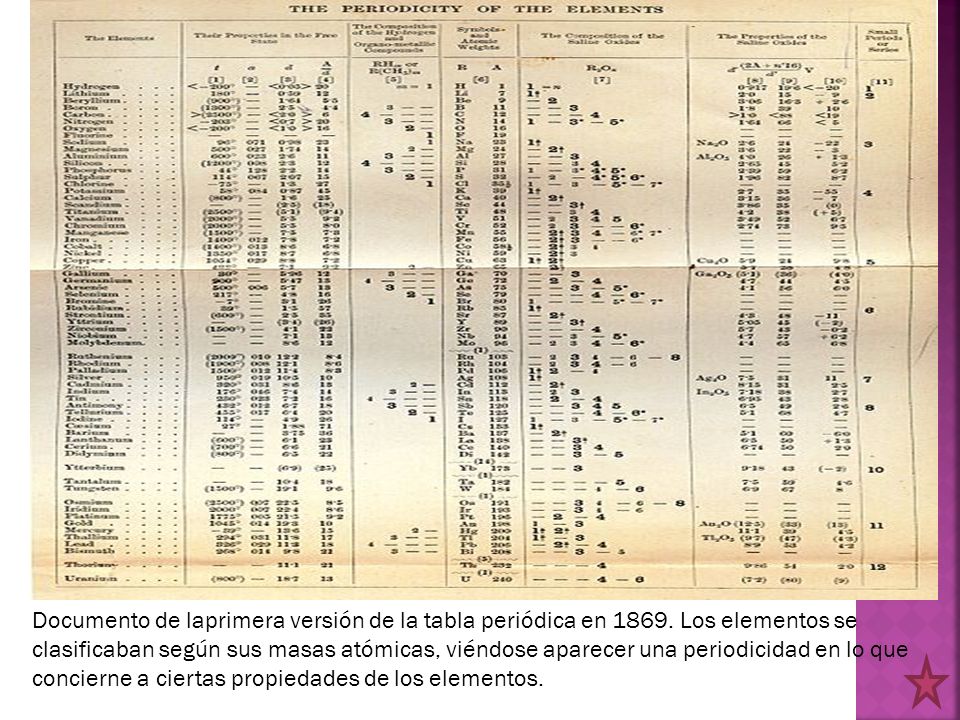
La clasificación que Mendeleiev propuso, presentaba una dificultad que era tratar la masa atómica como criterio para ordenar los elementos, ya que esto supondría que muchos elementos deberían estar colocados fuera del lugar que le correspondía, para así poder quedar agrupado por similitud en cuando a propiedades.
Por lo tanto, se deberían hacer compatibles tanto las propiedades químicas de los elementos que se repetían, como las masas atómicas, pero aun así no parecía ser suficiente para obtener una ordenación coherente.
Referencias:
http://quimica.laguia2000.com/general/tabla-periodica-de-mendeleiev#ixzz3yajJBU00
http://www.astromia.com/biografias/mendeleyev.htm
https://es.wikipedia.org/wiki/Dmitri_Mendel%C3%A9yev
MATERIAL:
- 16 tubos de ensayo.
- Gradilla
- Pipeta
- Guantes
- Cubrebocas
- Lentes.
- Masking tape
- Plumón permanente negro.
SUSTANCIAS:
- Aluminio en granalla
- Azufre sublimado
- Carbono
- Cobre
- Hierro
- Magnesio
- Yodo
- Zinc
- Disolución de ácido clorhídrico (3.65 ml por 1 litro de solución)
- Disolución de cloruro de cobre (13g por 1 litro de solución)
PROCEDIMIENTO:
- Observen las muestras de los elementos que les proporcionó la profesora y describan sus propiedades físicas (color, textura, etc).
Elemento
|
Propiedades físicas
|
Reacción con cloruro de cobre.
|
Reacción con ácido clorhídrico.
|
Al
| Plateado, rasposo, frágil y quebradizo | Medio, se expande y se oxida, con una coloración amarilla. | Lenta, sin cambios |
S
| Es poroso, tiene un color verde pastel y es granular. | Rápida, se hizo un liquido mas pegajoso. | Rápida, no es soluble. |
C
| Es quebradizo, de color negro y es fino. | Rápido, su coloración se hizo más obscura. | Medio, formación de capa superficial. |
Cu
| Brilloso, frágil, ligero, maleable | Lenta, no hubo gran modificación. | Rápida, dilatación de volumen. |
Fe
| Con apariencia áspera, de color negro y brilloso. | Rápida, se comprime con el oxigeno. Su coloración paso de ser negra a ser roja. | Lenta, sin cambios. |
Mg
| Color gris, maleable, áspero y frágil. | Rápido, burbujea, presenta desgaste y su coloración cambio a verde. | Medio, burbujea. |
I
| Granular, en color gris, es solido y tenaz. | Lenta (leve), una coloración amarilla. | Rápido, se presento una leve coloración amarilla. |
Zn
| Tenaz, plateado, y solido. | Rápido, se presento una coloración negra. | Sin cambios. |
2. Rotulen los tubos de ensayo (2 para cada elemento) utilizando el símbolo químico del elemento.
3. Acomódenlos en dos filas una para el cloruro de cobre y otra para el ácido clorhídrico.
4. Pongan en cada tubo una muestra de cada elemento.
5. En la primera fila de tubos agreguen 1 ml de cloruro de cobre de uno por uno para que observen qué sucede y registren los resultados en la tabla. Presten atención tanto al tipo de cambio como a la rapidez con que se produce.
6. Hagan lo mismo con la otra fila de elementos pero ahora con el ácido clorhídrico. Registren sus observaciones en la tabla.
OBSERVACIONES (IMÁGENES Y DESCRIPCIÓN):
Primeramente se rotularon todos y cada uno de los tubos de ensayo, que posteriormente se acomodaron en dos filas (una para el cloruro de cobre y la otra para el ácido clorhídrico).
Aquí están la pipeta, el cloruro de cobre y el ácido clorhídrico.
Ya una vez teniendo los materiales necesarios iniciamos con el experimento.
Primero le colocamos el cloruro de cobre a todas las sustancias.
La primer sustancia fue el aluminio.
El Azufre.
Carbono
Hierro.
Magnesio
Yodo
Zinc
Posteriormente a cada sustancia le pusimos ácido clorhídrico, pero esta vez a los otros tubos de ensayo.
Aluminio (Al)
Azufre (S)
Carbono (C)
Hierro (Fe)
Cobre (C)
Yodo (I)
Magnesio (Mg)
Y por ultimo el Zinc (Zn)
ANÁLISIS:
- Investiguen la ubicación de esos elementos en la tabla periódica y determinen si su clasificación se relaciona con su ubicación en dicha tabla.
- Aluminio - Metálico.
- Cobre - Metálico.
- Magnesio - Metálico.
- Hierro - Predominantemente metálico.
- Yodo - Predominantemente no metálico.
- Azufre -No metálico
- Carbono - No metálico
- Zinc - Anfótero1
1. Una sustancia anfótera es aquella que puede reaccionar ya sea como un ácido o como una base.
CONCLUSIÓN:
Observamos las propiedades físicas y químicas de los elementos, y con la combinación de dos diferentes sustancias, vimos ademas la reacción que tuvieron las sustancias y que en las propiedades individuales de cada uno de los elementos se ve la diferencia de reacción de cada elemento.
Por ello podemos decir que cada elemento tiene diferente modo de reaccionar ante otra sustancia, pero también existen sustancias que comparten características aunque no sean del mismo elemento.





















No hay comentarios:
Publicar un comentario